info@genecompany.com|
基因快讯|


技术交流

扫描二维码
或添加“GeneGroup003”
获取更多更新资讯
商城订购

扫描二维码
或添加“基因商城(GeneMart)”
手机下单,快人一步
售后服务

扫描二维码
或添加“GeneGroup005”
获取更快速售后支持
Western Blot困惑:为何我的蛋白条带不在理论“该在”的位置?

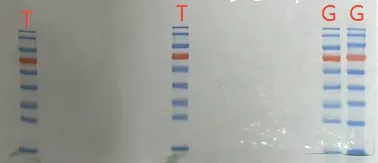
想必做WB的同学都或多或少出现过在根据Marker条带判断目标蛋白的表观分子量时发现与预期分子量不符的情况,这究竟是怎么回事呢?是实验失败了吗?还是Marker不准?抗体有问题?亦或者蛋白本身有“猫腻”呢?本文将系统解析造成这种不一致的多种原因,帮助大家正确解读结果、优化实验并避免误判。 NEXT SDS-PAGE分离原理的再认识 SDS-PAGE 通过SDS 电荷均一化(使蛋白带均匀负电荷)和凝胶分子筛效应分离蛋白。其分离基础是完全变性还原条件下线性多肽链的分子量(更准确地说,是迁移率与其分子量对数成反比)。此时,Marker 的指示才接近真实分子量。 在区分清楚理论分子量和表观分子量后,我们接下来将深入解析下不一致的“罪魁祸首”。 蛋白翻译后修饰(PTMs) ▪糖基化:添加糖链 → 增大水合体积 → 迁移变慢 → 表观 > 理论 ▪磷酸化:添加磷酸基团 → 电荷效应为主 → 迁移略快/略慢 → 多修饰可累加 ▪泛素化/SUMO化:添加大肽链 →分子量显著增大 → 迁移变慢 → 表观 >> 理论 (常伴拖尾) ▪脂化:添加疏水基团 → 影响SDS结合/聚集 → 迁移异常 (快/慢不定) ▪切割:前体变小 → 迁移变快 → 表观 < 理论 (如酶原激活、信号肽切除) 蛋白结构特性 ▪氨基酸组成:特定氨基酸(如 Pro, Gly)影响肽链构象/刚性 → 迁移异常 ▪二硫键:还原不足 → 折叠残留 → 迁移变慢 → 表观 > 理论 ▪疏水性:极端疏水 → SDS 结合/变性不足 → 迁移变慢 ▪多结构域/异常构象:复杂结构 → 影响 SDS 结合/分子形状 → 迁移异常 实验因素 ☑ 样品制备 ▪变性/还原不足:(常见!) SDS结合不均/二硫键残留 → 蛋白未线性化 → 迁移变慢 ▪过度煮沸:易致聚集 (甘油/还原剂不足时尤甚) → 聚集体滞留胶孔/顶部 ▪蛋白酶降解:蛋白裂解 → 小片段条带出现于低分子量区或主带下移 ☑ 电泳条件 ▪凝胶浓度不当:浓度过低 → 低分子量蛋白分离差;浓度过高 → 高分子量蛋白分离差 ▪缓冲系统:不同的缓冲液系统蛋白分子量指示可能略有差异,建议结合Marker 说明书确定 ▪电压/时间不当:过高/过长 → 条带扩散、变形 (e.g., 微笑/哭脸效应) → 定位不准 ☑ Marker本身 ▪Marker 选择:蛋白组成/修饰状态 (e.g., 预染Marker常为添加染料的重组蛋白) → 影响迁移“标准性” ▪Marker 批次/质量:批次差异/质量差 → 条带模糊、偏移 ▪Marker 适用性:特定条件 (e.g., 凝胶浓度、缓冲液如 Tris-Tricine) 下可能非线性迁移 其他因素 ▪同源蛋白/异构体:存在剪接变体或翻译后修饰不同的亚型,可能跑出多条带或位置有差异。 了解了以上原因,想必大家就明白了:蛋白Marker指示的表观分子量与理论分子量不一致是常态而非例外,主要由蛋白翻译后修饰、结构特性以及可控的实验因素共同导致。这种“不一致”本身可能蕴含着重要的生物学信息(如蛋白修饰状态、激活状态、存在异构体等),不应简单视为实验失败。 我们应系统性地排查(抗体特异性、实验操作、蛋白特性),结合文献和验证实验,正确解读条带位置,避免误判。 只有掌握这些原因,才能找出解决方法,提升实验技能,更深入地理解研究对象。 广告一波 货号:PM-S001 电泳/转膜均可获得清晰不弥散条带; 红绿蓝三色预染,标记位置符合常规使用习惯; 兼容SDS-PAGE和Bis-Tris (MOPS/MES)不同凝胶缓冲液体系! 客户实测数据 与竞品T品牌相比,基因生物Marker 上样量仅3 μl,条带清晰锐利



▪抗体特异性:抗体识别了非特异性条带或降解产物(这是造成“假”不一致的重要原因!需通过敲除/敲低实验、不同抗体验证、质谱等确认条带特异性)。

优势:
条带锐利,分布均匀,分子量准确;