info@genecompany.com|
基因快讯|


技术交流

扫描二维码
或添加“GeneGroup003”
获取更多更新资讯
商城订购

扫描二维码
或添加“基因商城(GeneMart)”
手机下单,快人一步
售后服务

扫描二维码
或添加“GeneGroup005”
获取更快速售后支持
一种快速简便的进行线粒体膜电位检测的方法

背景简介:
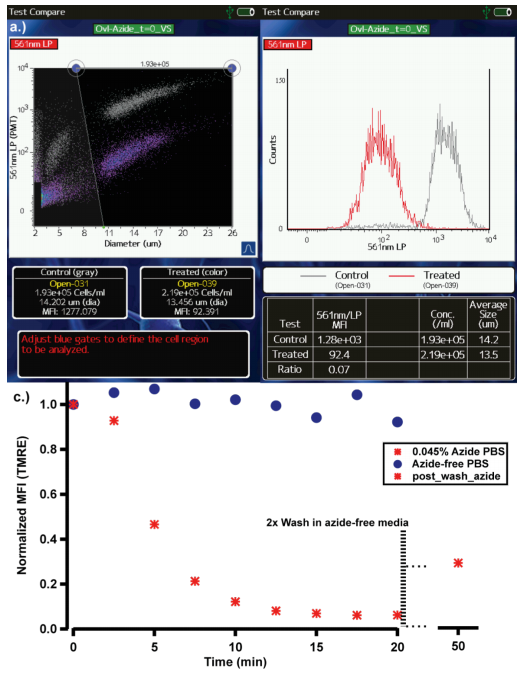
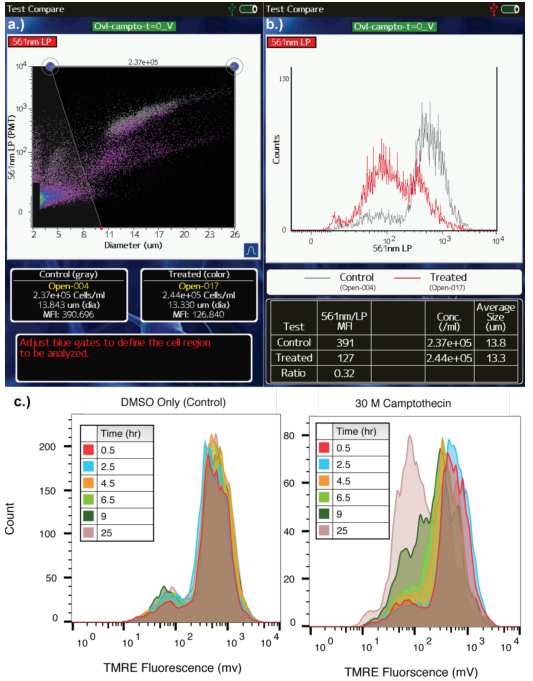
线粒体是细胞新陈代谢的主要细胞器,起着“能量工厂”的作用。线粒体内部通过一系列的氧化反应去氧化丙酮酸和NADH,以产生储存能量的ATP分子。而这一系列反应的驱动力是线粒体膜上电化学质子的梯度差,也叫做膜电位。由于这种质子的梯度差为磷酸化和氧化反应提供了“驱动力”,因此它也被当作一个衡量细胞的整体健康状态的指标,同时也可作为研究环境毒性对细胞新陈代谢影响的一个定量监测的指标。 那么该如何来监测线粒体的膜电位呢? 今天介绍一个简单的方法,即Moxi GO II新一代流式细胞分析仪结合TMRE染料法。 TMRE(四甲基罗丹明高氯酸乙酯)是一种线粒体特异的具有红橙色荧光(540/595nm Ex/Em)的阳离子染料,具有膜通透性,会在带负电荷的线粒体膜中迅速积累。线粒体的膜电位越高,TMRE的积累量越多,荧光值越高,因此可以通过检测TMRE荧光值的强度来定量地评估线粒体膜电位,从而评估细胞的健康状态。 在以下的案例中,我们将展示如何使用ORFLO的Moxi GO II 新一代流式细胞分析仪来进行线粒体膜电位变化的检测。 实验一:叠氮化钠处理 叠氮化钠sodium azide是一种已知的线粒体抑制剂,广泛应用于抗菌试剂中。首先用TMRE对Jurkat细胞进行染色,然后分成两份。分别加入PBS和含0.045%叠氮化钠的PBS,继续孵育。每隔2.5min检测一次,总共检测20min,然后用PBS将处理组中的叠氮化钠洗去,再加入PBS孵育13min,再检测一次,将获得的数据用IGOR PRO软件生成时间趋势数据图。 图1:0.045%的叠氮化钠处理Jurkat细胞后线粒体膜电位的变化进程 a. Moxi GO II散点图,灰色表示处理0min时,红色表示处理20min时 b. Moxi GO II直方图,灰色表示处理0min时,红色表示处理20min时 c. 不同的时间点进行TMRE的检测,均一化后的荧光值结果图 图1ab展示的是Moxi GO II的检测结果,分别以散点图和直方图的形式展示。图1a中横坐标代表细胞尺寸,纵坐标代表TMRE的荧光强度,灰色的点代表处理0min时的细胞,紫/红色的点代表处理20min时的细胞,可以看出处理20min后,TMRE的荧光值明显降低,即线粒体的膜电位明显降低。 如图1c所示,对照组中TMRE的信号值不会随着时间延长而降低,而叠氮化钠处理的细胞样品中,随着时间的延长,线粒体膜电位快速的降低,TMRE的信号值快速的降低,所获得的结果与文献(1.2.3)报道的一致,即叠氮化钠作为一种强有力的线粒体功能干扰试剂与线粒体膜和细胞器去极化相关。 实验二:叠氮化钠处理 图2:喜树碱处理Jurkat细胞后线粒体膜电位变化进程 a. Moxi GO II上(TMRE)荧光散点图叠加 b. t=0h(灰色)和t=25h(红色/紫色)的TMRE荧光直方图叠加 c. 不同时间点样品的TMRE荧光直方图叠加 从图2a可以看出,Jurkat细胞在用药后0小时和25小时时,线粒体膜电位是降低的,说明喜树碱处理可以降低线粒体膜电位。另外值得注意的是,在图2a散点图数据上可以看到,在喜树碱处理后,伴随着TMRE荧光值的降低(Y轴),X轴对应的细胞尺寸也是相应减小,这也是符合细胞凋亡的形态学变化的。而细胞尺寸的数据是通过细胞尺寸检测的金标准库尔特原理进行的精确检测。图2b清晰的展示了随着时间的延长线粒体膜电位逐渐降低。另外Moxi GO II可以保存FCS3.1标准数据格式,可以很容易导入到流式细胞软件中进行分析。 图2c显示用Flowjo X软件将对照组和实验组不同时间点的数据整合在一起,可以清晰的看出药物处理后线粒体膜电位的变化情况。 在该应用中,使用 Moxi GO II和TMRE染料可以便捷的进行不同药物处理后线粒体膜电位的检测,ORFLO Moxi GO II系统是简单、快速、有效的流式细胞术平台,可广泛的应用于细胞分析。该系统通过公认的金标准库尔特原理进行细胞计数和尺寸检测,同时使用532nm激光器、561nm/ LP滤光片和525/45nm滤光片、双PMT进行荧光检测。该荧光通道可用于许多常见的荧光基团,包括藻红蛋白(PE,用于免疫标记),碘化丙啶(PI,用于细胞活性),GFP/RFP (用于转染效率评估)等。Moxi GO II利用一次性检测芯片,无需提前准备机器、无需清洁、无需维护,仪器即开即用,无需关机,10秒内即可运行完一个测试。这些特点使得Moxi GO II适合于快速测试和分析的实验,如该文所示的线粒体膜电位的动力学检测。 参考文献: 1. Rahn, C. A., Bombick, D. W. & Doolittle, D. J. Assessment of mitochondrial membrane potential as an indicator of cytotoxicity. Fundam. Appl. Toxicol. 16, 435–448 (1991). 2. Johnson, L. V, Walsh, M. L., Bockus, B. J. & Chen, L. B. Monitoring of relative mitochondrial membrane potential in living cells by fluorescence microscopy. J. Cell Biol. 88, 526 LP-535 (1981). 3. Safiulina, D., Veksler, V., Zharkovsky, A. & Kaasik, A. Loss of mitochondrial membrane potential is associated with increase in mitochondrial volume: Physiological role in neurones. J. Cell. Physiol. 206, 347–353 (2006). 4. Elmore, S. Apoptosis: a review of programmed cell death. Toxicol. Pathol. 35, 495–516 (2007). 5. Heiskanen, K. M., Bhat, M. B., Wang, H.-W., Ma, J. & Nieminen, A.-L. Mitochondrial Depolarization Accompanies Cytochrome cRelease During Apoptosis in PC6 Cells . J. Biol. Chem. 274, 5654–5658 (1999). 6. Wang, C. & Youle, R. J. The Role of Mitochondria in Apoptosis(). Annu. Rev. Genet. 43, 95–118 (2009). 扫二维码|添加技术人员企业微信,了解更多!