info@genecompany.com|
基因快讯|


技术交流

扫描二维码
或添加“GeneGroup003”
获取更多更新资讯
商城订购

扫描二维码
或添加“基因商城(GeneMart)”
手机下单,快人一步
售后服务

扫描二维码
或添加“GeneGroup005”
获取更快速售后支持
高分文献中的定量Western Blot是如何实现的?

Western Blot 是分子生物学中研究蛋白的经典方法,被广泛应用于检测细胞或组织样本中蛋白表达量。传统的Western Blot被认为是定性或半定量Western Blot,那么高分文献中的定量Western Blot(Quantitative Western Blot)是如何实现的?基因小编和您一起来了解定量Western Blot。首先需要明确:什么是定量Western Blot?为什么要对Western Blot进行定量分析?如何实现定量Western Blot?
一 、什么是定量Western Blot?
定量Western Blot:是指信号和靶蛋白量成很好的线性比例关系,如果用标准蛋白做标准曲线可以得到目的蛋白准确的定量信息,与Real-Time PCR(以下简称qPCR)有异曲同工之妙。文献中定量Western Blot使用更多的成像技术是LI-COR Odyssey双色近红外荧光成像,并且经查证定量Western Blot领域中LI-COR Odyssey有超过一万多篇文献数量(HighWire)。
二、为什么要对Western Blot进行定量分析?
分子生物学研究中,核酸水平的研究常用PCR的方法进行定性或半定量研究,用qPCR的方法进行定量分析;而在蛋白质水平的研究,传统的Western Blot仅能进行定性或半定量研究,想要实现准确的定量研究,必须使用定量Western Blot的方法。很多发表的文章中都采用qPCR方法对mRNA表达水平进行定量分析,并同时用LI-COR Odyssey 定量Western Blot方法对蛋白表达水平进行定量分析。如2015年发表在Cell Stem Cell上的一篇文章(介绍神经精神疾病建模过程使用基因条件敲除,发现NRXN1中杂合突变引起突触传递缺陷现象,证明人类神经元中杂合NRXN1突变会伴随CASK蛋白表达上调),作者分析了mRNA水平包括CASK mRNA(使用定量PCR方法,图A)和蛋白水平的变化(使用LI-COR Odyssey 定量Western Blot方法,图B),文章显示cKO和cTr NRXN1突变体iN细胞中CASK蛋白水平增加60%-80%,定量PCR和定量WesternBlot 结果相辅相成,与其他方法共同揭示了NRXN1的杂合失活直接损害人类神经元突触功能。

A: 总mRNA水平定量分析用qPCR方法
B: 蛋白表达差异定量分析用LI-COR Odyssey 定量Western Blot法
2016年发表在Neuron 上的文章(介绍一个灵长类lnc RNA-lncND在神经元发育过程中调节Notch信号通路)中,内源性NOTCH-1和NOTCH-2 mRNA(定量PCR方法)和蛋白的表达(LI-COR Odyssey 定量Western Blot方法)在miR-143-3p模拟物存在下显着下调(图D和F)。Notch信号通路的下游靶标HES1和HEY1也被下调(图E),定量PCR和定量Western Blot方法证实miR-143-3p对该通路的影响。(Rani et al l.,2016, Neuron)。
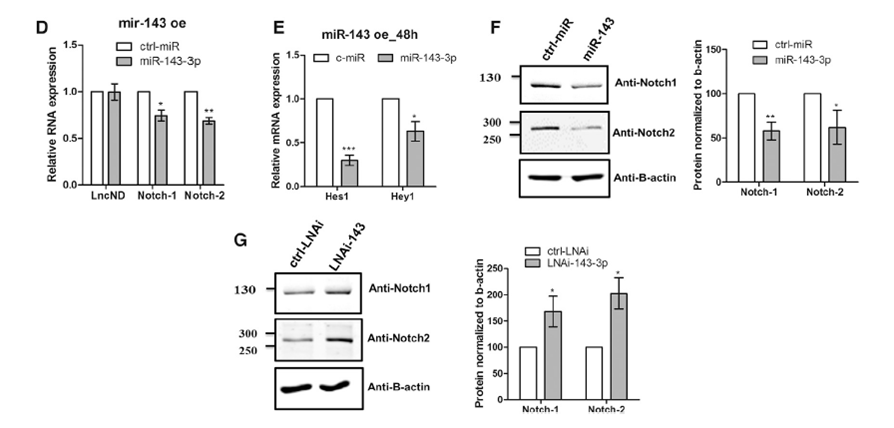
D、E : mRNA水平验证miR-143-3p对于靶标Notch1和2表达的调节作用
F、G: 蛋白表达水平验证miR-143-3p对于靶标Notch1和2表达的调节作用
三、如何实现定量Western Blot?
1.获得稳定的Western Blot信号
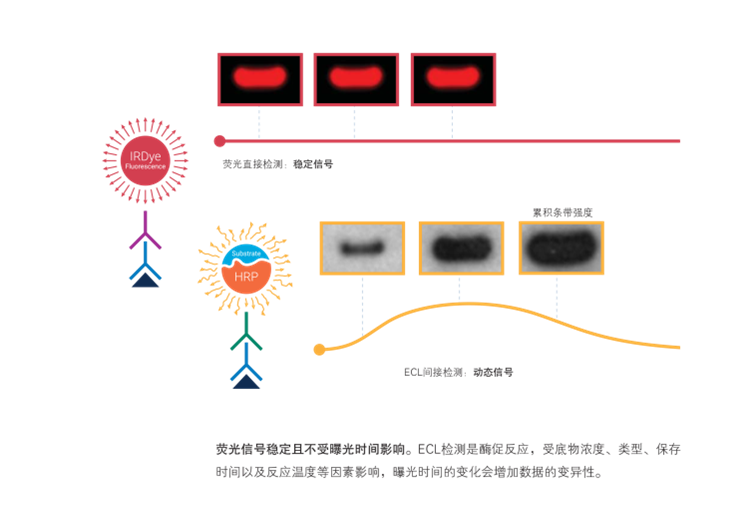
选用近红外荧光成像获得稳定的近红外荧光Western Blot信号,意味着高重复性、准确的定量数据。与化学发光Western Blot的动态信号(信号受曝光时间影响,也受底物浓度、底物类型、温度等多种因素的影响)不同,稳定的近红外荧光信号不受曝光时间影响,信号与靶蛋白浓度成比例,能准确定量。
2007年发表在PNAS文章作者比较了不同的Western Blot 检测方法的定量准确性问题。作者需要定量分析三种感兴趣的蛋白p53、Hdm2、 Hdmx的表达水平,其中Hdm2、 Hdmx两种蛋白丰度轻微的波动就会对p53有明显的调控作用,所以作者设置了不同的Western Blot 检测方法--化学发光和近红外荧光法,来评估那种方法定量更准确,结果证明Odyssey 近红外荧光Western Blot结果更准确,线性范围更宽,而ECL化学发光法目标蛋白的线性范围有限(高丰度蛋白更容易过曝),定量准确性和重复性也没有近红外荧光检测法好(Wang et al,. Salk Institute,PNAS )。
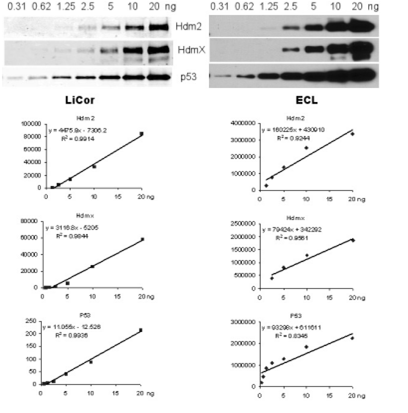
图二: 两种不同的Western Blot 检测方法Odyssey 近红外荧光法和ECL化学发光法 定量准确性比较,Odyssey 近红外荧光Western Blot结果更准确,线性范围更宽
多色近红外荧光Western Blot允许同时检测两个及以上目标蛋白质,更加准确,重复性也更高。避免了Stripping和Reprobing导致的假阳性或信号损失。

图三
2. 宽广的线性动态范围
Western Blot检测系统的线性动态范围值就是指信号强度与蛋白质的丰度成比例范围。在Western Blot许多实验中都涉及到了同一张膜上不同药物或条件下蛋白表达有差异,宽广的动态范围能跟保证一次成像就可获取所有的信号即采集弱信号的同时避免强信号饱和,从而实现真正的定量Western Blot。 JBC(The Journal of Biological Chemistry)等期刊杂志明确表示压片法化学发光线性范围较窄,并明确建议使用像LI-COR Odyssey 等具有宽动态范围的成像平台,避免Western Blot数据丢失。
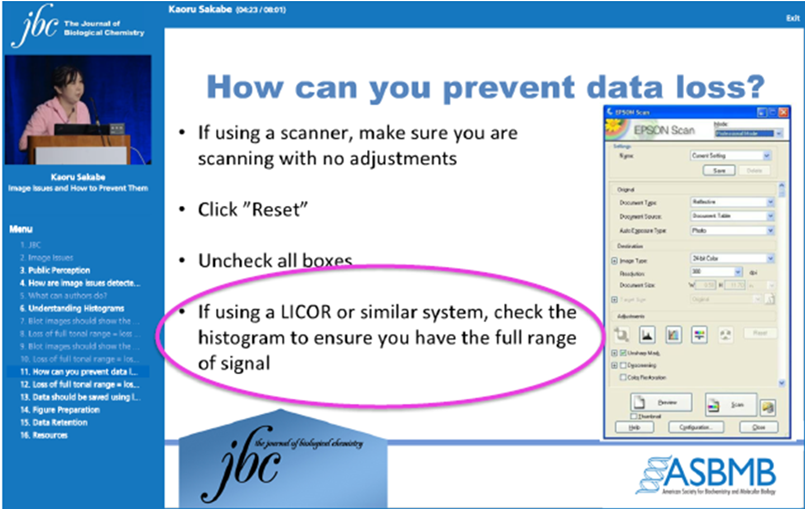
Odyssey成像系统具有更宽广的动态范围,可以采集到Western Blot更准确的定量数据。
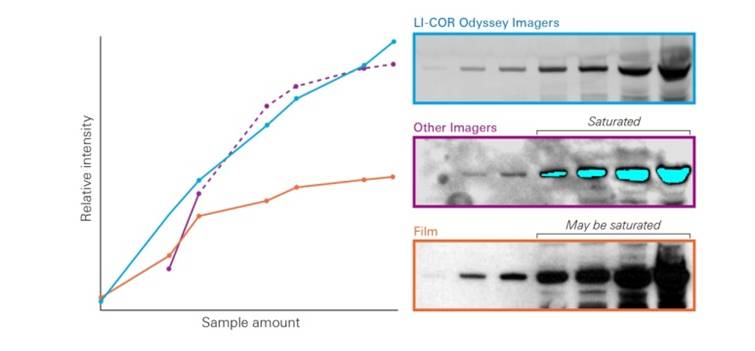
图四
3. 选择合适的均一化方法
Western Blot实验往往需要进行均一化分析,以校正不同样本之间、不同泳道之间的差异,获得准确、可重复的Western Blot数据。常见的均一化方法包括:看家基因、总蛋白染色、信号蛋白(如磷酸化等蛋白修饰研究中信号蛋白)等均一化方法等。
用看家基因做均一化使用范围广,但不是所有实验都适合用看家基因进行均一化,因为看家基因有时在不同的组织、细胞中表达会发生变化;不同的实验条件可能也会影响看家基因的表达。
REVERT Total Protein Stain总蛋白染色均一化不同于看家基因,不再受生物学差异的、实验条件的影响,是近年来流行一种均一化方法。
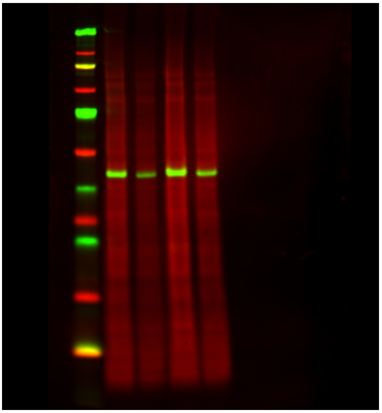
图五 REVERT试剂对总蛋白染色,在Odyssey 700nm(红色)通道下成像;靶蛋白在Odyssey 800nm(绿色)通道下成像
发表在2017年Nature Communications上的文章中(研究果蝇节律性基因时间依赖性表达研究),发现一种名为PER的蛋白在不同的样本(年老、年轻果蝇)、不同条件(Zeitgeber Time 8,12,16,0,4,8 )下,PER在RNA和蛋白表达水平出现了与以往时间依赖性表达相反的结果,以此揭示了果蝇核心的昼夜机制可能在年老时会发生变化,其中PER蛋白Western Blot均一化时使用REVERT Total Protein Stain总蛋白染色的方法,这种均一化方法不再受样本类型、实验条件差异的影响,为Western Blot均一化提供了另一种选择。
因此选择一种符合实验目的、生物学条件的均一化方法能给你带来准确、可重复、可发表的高质量数据。无论您选择哪一种均一化方法,LI-COR Odyssey 成像系统都能提供更准确的定量Western Blot结果。
参考文献:
[1] ChangHui Pak et al. Human Neuropsychiatric Disease Modeling using Conditional Deletion Reveals Synaptic Transmission Defects Caused by Heterozygous Mutations in NRXN1[J] 2015.Cell Stem Cell 17,316-328
[2] Rani et al.A Primate lncRNA Mediates Notch Signaling during Neuronal Development by Sequestering miRNA[J],2016,Neuron 90,1-15
[3] Wang Y V, Wade M, Wong E, et al. Quantitative analyses reveal the importance of regulated Hdmx degradation for p53 activation.[J]. Proceedings of the National Academy of Science, 2007, 30(1):17-25.
[4] Rachael C et al. Circadian deep sequencing reveals stress-response genes that adopt robust rhythmic expression during aging.[J] 2017 ,NATURE COMMUNICATIONS | 8:14529 | DOI: 10.1038/ncomms14529