info@genecompany.com|
基因快讯|


技术交流

扫描二维码
或添加“GeneGroup003”
获取更多更新资讯
商城订购

扫描二维码
或添加“基因商城(GeneMart)”
手机下单,快人一步
售后服务

扫描二维码
或添加“GeneGroup005”
获取更快速售后支持
核酸电泳常见问题分析及解决方案

核酸电泳是一种核酸分离、鉴定和纯化的常用方法,广泛应用于分子生物学应用领域。一旦核酸电泳过程中遇到问题,那么就可能会影响下游实验进度,最终降低实验工作效率。为了让大家的实验顺利完成,小编整理了一些关于核酸凝胶电泳的常见问题,帮助大家排忧解难。
PART.1
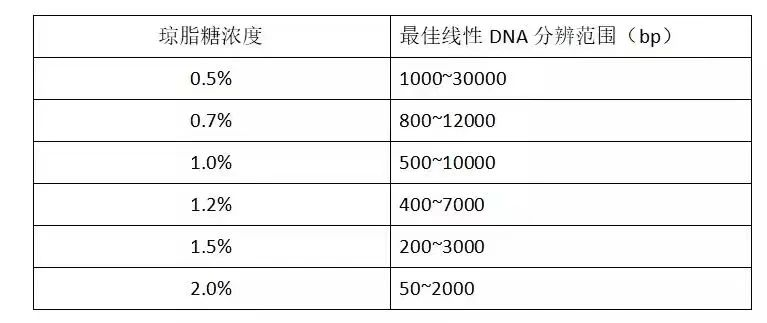
无条带或条带较弱 上样量不足 尝试增加上样量。 核酸降解 在核酸提取和电泳过程中,使用分子生物学等级试剂,切勿使用含核酸酶的耗材,避免核酸酶污染。 电泳缓冲液使用不当 TAE缓冲液短期内更适用于分离大片段,长时间运行易产热;TBE缓冲液对于更短片段更好,适用于长时间运行而不易导致过热,但可能会减缓线性dsDNA的迁移。 DNA跑出凝胶 DNA小片段分子量较小,迁移速率快,容易跑出凝胶。可以适当减少电泳时间、降低电压或使用溴酚蓝等示踪剂来标识条带,避免跑出凝胶。 电极反接 确保将电极正确连接至电源,放置凝胶时,凝胶孔应与负极位于同侧。 正极 --- 红色 ,负极 --- 黑色 光源错误 如果使用荧光染料进行染色,请检查其激发波长以确保使用的光源合适。EB染料使用紫外光源,安全染料如SYBR Green、Gelstar、GeneFinder使用波长400-500nm的蓝绿可见光检测。 紫外/蓝光凝胶成像系统 PART.2 条带弥散 核酸降解 在核酸提取和电泳过程中,避免核酸酶污染。 核酸纯度差,样品含大量蛋白质或盐 纯化样品去除盐和蛋白质,或使用SDS-filled loading dye制备样品。 电泳条件不合适 电泳时选择合适的电泳缓冲液并需要经常更换,根据需要分离的核酸片段大小调整电压。 核酸电泳运行电压 (V) = 电极间的距离 (cm) x 5-10 V/cm。 PART.3 条带变形或拖尾 上样孔形成不佳 可在制胶前清洁制胶梳,胶不宜太厚,凝胶凝固后小心移除凝胶梳,防止损坏上样孔。 上样量过大 上样量过大,易出现拖尾、弯曲或U形条带以及融合条带。 凝胶孔中有气泡 上样时避免有气泡滞留在孔内,否则容易出现条带变形。 电泳条件不合适 根据核酸片段大小使用合适的电压和电泳缓冲液。同时注意电泳时间过长会导致过度加热、样品变性和条带扩散。 电压对DNA电泳的影响 左图,高电压导致的微笑型条带;右图,电压合适条件下的正常电泳条带。 PART.4 条带分离不佳 琼脂糖凝胶浓度使用不当 不同分子量大小的核酸片段都有其适合的琼脂糖浓度,如果琼脂糖浓度使用不当,可能导致目的条带分离不佳。 不同浓度琼脂糖凝胶对应的线性DNA分辨范围 上表展示了不同浓度琼脂糖凝胶所对应的线性DNA合适的分辨范围,可根据核酸片段大小选择合适的琼脂糖浓度以取得较好的分离效果。 BIOWEST琼脂糖 不含核酸酶,具有高强度、低背景等优点。 电泳缓冲液失效 电泳缓冲液多次使用后,离子强度低,缓冲能力减弱,建议经常更换。采用正确方法制备电泳缓冲液,确保凝胶制备和电泳缓冲液相匹配,可选用能支持2 h以上电泳的强力缓冲液。 PART.5 分离或迁移异常,条带大小不正确 琼脂糖凝胶制备不当 使用与电泳缓冲液相同的缓冲液溶解琼脂糖,煮沸琼脂糖凝胶后,不应剩余任何未溶解粉末或未融化固体。 凝胶制备不均匀 凝胶不平整或上样孔倾斜 将凝胶槽放在平坦表面上,灌注凝胶并插入梳子。凝胶梳应完全垂直插入凝胶表面,与凝胶上边缘平行,并在凝胶凝固过程中保持稳固。 核酸降解或形成蛋白-核酸复合物 可重新制备样品,或使用含SDS的上样缓冲液并加热样品,破坏蛋白质和核酸之间的相互作用。 含有相同分子量的DNA片段由于结构或序列的差异而有不同迁移率 质粒DNA的不同构象 (如超螺旋、线性、松弛/开口) 在电泳中显示出不同的迁移率,需提前判断DNA是否有特殊结构。 带切口质粒是一个松弛、开放的环状构象,体积大,凝胶中迁移缓慢;线性质粒迁移速度稍快;完好无损的质粒最紧凑,迁移速度最快。 此外,富含AT碱基的DNA迁移率比同分子量富含GC碱基的DNA片段慢。 以上就是本期关于核酸电泳常见问题及解决方案的全部内容啦,相关产品信息可添加技术人员企业微信。