info@genecompany.com|
基因快讯|


技术交流

扫描二维码
或添加“GeneGroup003”
获取更多更新资讯
商城订购

扫描二维码
或添加“基因商城(GeneMart)”
手机下单,快人一步
售后服务

扫描二维码
或添加“GeneGroup005”
获取更快速售后支持
选择适合的基因转染技术

基因转染技术有多种分类方法,根据导入方法的不同,可分为物理基因转染法、化学基因转染法和生物基因转染法。
几种常见转染方法的比较:
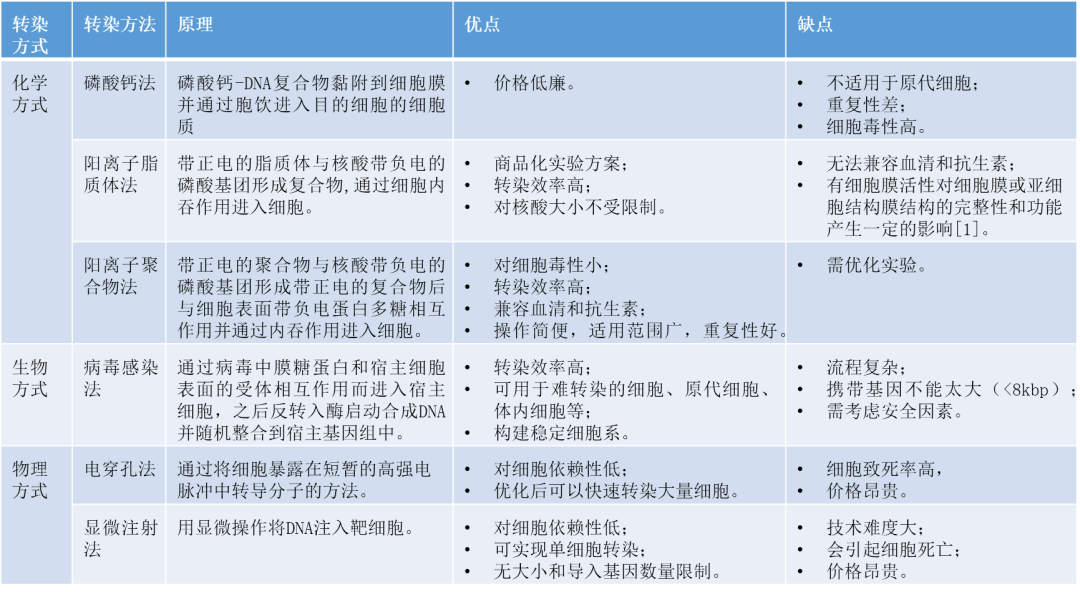
理想细胞转染方法,应具有转染效率高、不影响细胞的正常生理活动、细胞毒性小等优点,且应满足3个条件:①保证转入细胞的基因不被细胞内核酸酶所降解;②转入细胞的基因能通过质膜进入细胞核中;③对宿主细胞无毒害作用[2]。
阳离子聚合物基因载体中,聚乙烯亚胺(PEI)是目前研究最广泛的,在许多不同细胞中均表现出较高的转染效率。
PEI 为有机的大分子化合物,每两个碳原子有一个可以质子化的氮原子,由于这些氮原子构成的伯、仲、叔氨集团的pKa值不同,使PEI几乎在任何Ph条件下都有吸收质子的能力。这一特性使得PEI能在内涵体的酸性环境中吸收H,使其渗透压增高,导致膜不稳定甚至破裂,从而使被吞噬的复合物中的DNA逃逸出来,避免DNA降解[3]。
PEI已在环境中广泛使用了30年,应用范围包括水净化、矿物提取、洗发水等,证明它是无害的[4]。这种多聚阳离子能将各种基因转入各种种属细胞其转染效果好而且细胞毒性低[5]。

法国斯特拉斯堡 Polyplus transfection®——专注转染试剂开发,助力基因、细胞治疗。
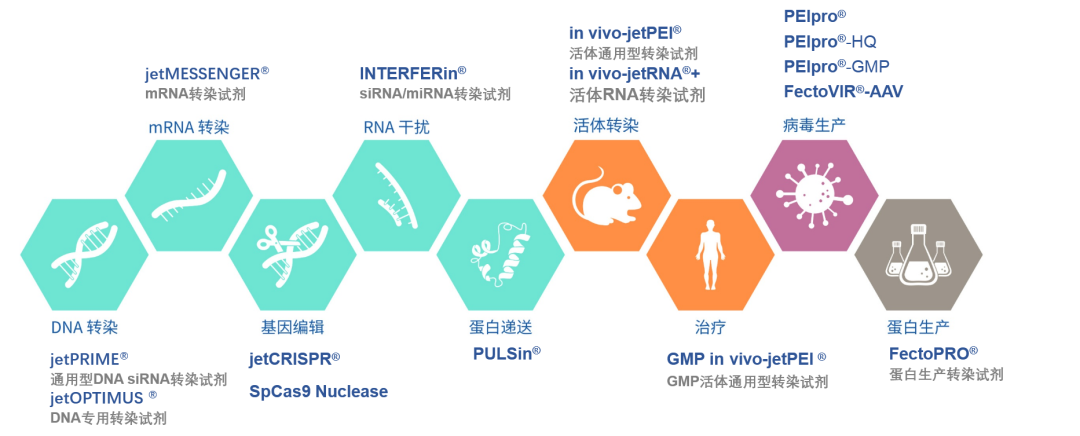
采用PEI技术,水溶性阳离子聚合物,具有转染效率高、细胞毒性低、操作简单、实验可重复性高、价格实惠、可用于规模化生产的多方面优势。
下面给大家分享几款适用于科研领域的当家花旦。
01
jetPRIME®-通用型DNA siRNA 转染试剂
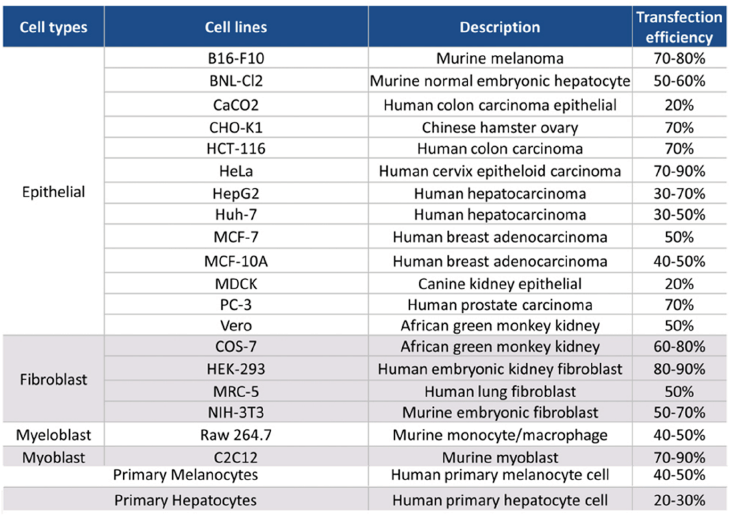
转染DNA和siRNA的试剂,应用范围广泛,质粒DNA、siRNA转染、基因编辑、病毒小规模包装生产,不同核酸共转染等均可适用。
特点:
较高的细胞活率(毒性小,对细胞温和);
性价比高,更少的试剂用量;
更简的操作步骤——即用型试剂(和血清、抗生素兼容,无需换液,试剂无需稀释);
卓越的转染效率(请参考下方的数据)。
已验证细胞转染效率列表:
02
jetOPTIMUS®-DNA专用转染试剂
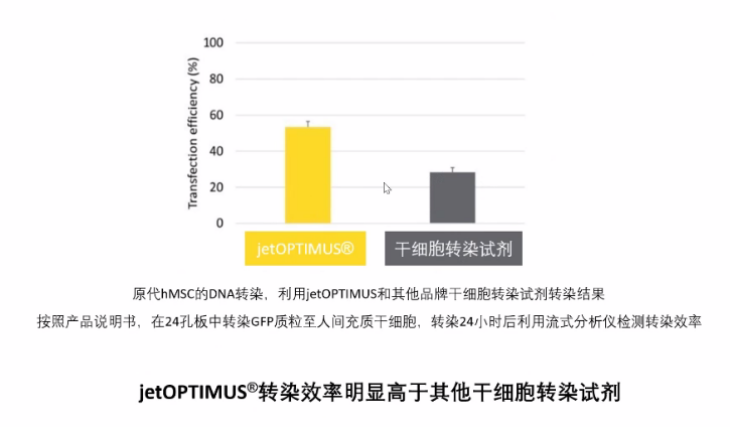
jetOPTIMUS®专为难转染细胞中转染DNA开发的试剂,适用于原代细胞、神经细胞、干细胞等。
特点:
细胞毒性低(保持良好的细胞活力和形态);
节省时间(优化的操作手册,直接使用);
操作简单(和血清、抗生素兼容,无需换液,试剂无需稀释;
转染效率高(HUVEC原代细胞转染效率达70%,干细胞转染效率高)。
人间充质干细胞(hMSC)转染效率:
03
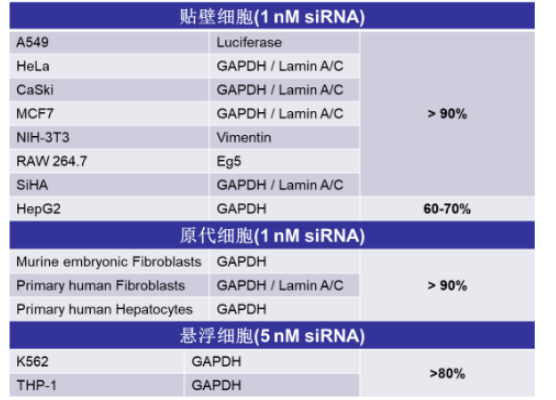
INTERFERin®-siRNA/miRNA转染试剂
INTERFERin® 用于贴壁和悬浮细胞siRNA转染。
特点:
细胞毒性低(保持良好的细胞活力和形态);
低的脱靶效应(使用低至1nM siRNA);
沉默效率高(请参考下方数据)。
多种细胞中达90%沉默效率:
04
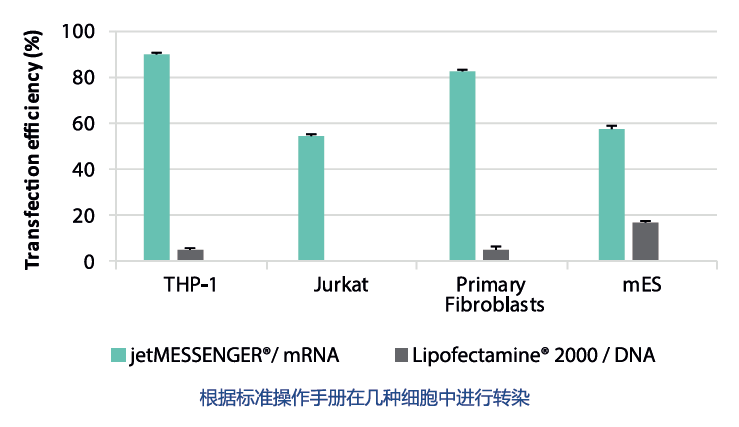
jetMESSENGER®-mRNA转染试剂
mRNA转染,将基因表达带到一个新的水平。
特点:
对细胞温和(维持良好的细胞活力);
对多种难转染细胞有效(可适用于处于缓慢分裂的静止期原代细胞和干细胞);
无与伦比的转染效率。
mRNA转染效率优于DNA转染效率:
05
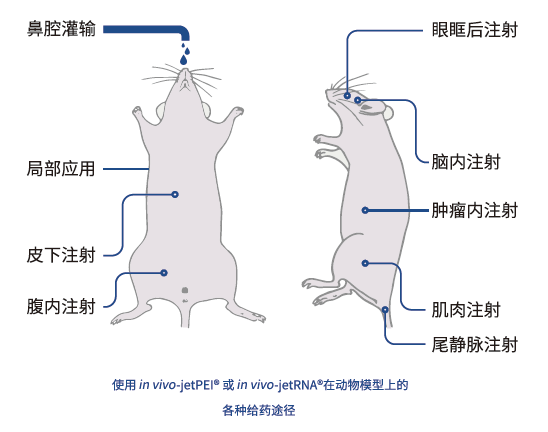
in vivo-jetPEI®-活体通用型转染试剂
in vivo jetPEI® 是聚合物注射型转染试剂,适用于多种动物的多种注射方式。可注射的核酸类型广泛包括DNA、siRNA和寡核苷酸等。
特点:
非病毒转染方法(无免疫原型、无毒性、无风险);
在治疗剂量内,无炎症反应;
结果可重复;
操作简便(两步操作);
给药方便(可用于各种注射途径,以达目标)。
Polyplus transfection®一家为先进生物制品、细胞及基因治疗生产提供从研发到商业化的上游解决方案的供应商。

工业领域的产品介绍下次约哟。
影响基因转染效率的因素很多包括细胞种类、转染时间、质粒结构、质粒的纯度、转染试剂与DNA 的比例等[6]。
如何得到纯度更高,内毒素更低更稳定,结构状态更好的质粒,请点击下方微信。
了解更多Polyplus transfection产品信息请扫描下方微信二维码联系技术支持。

[1]Zhou XT, Shen ZY, Yu SD et al.Optimization of transfection conditions for tranfecting siRNA to EOMA cells mediated by cationic liposome[J]. Acta Academiae Medicinae Xuzhou 2005 25(6):507-510.
[2]Xiang G, Kim K, Liu D. Nonviral gene delivery: What we know and what is next[J]. AAPS J, 2007,9(1):92-104.
[3]Kimberly L. Douglas. Toward development of artificial viruses for gene therapy: a compatative evaluation of viral and non-viral Transfection[J]. Biotechnology Progress, 2008,24:871-883.
[4]Bikales, M. & Overberger, M. (1985) Encyclopedia ofPolymer Science and Engineering (Wiley, New York), Vol. 1.
[5]王宇光,郑建华,赵璐等.聚乙烯亚胺介导的报告基因在体外转染效率的研究[J].哈尔滨医科大学学报2004 38(5):426~428。
[6]Lee E R,Marshall J,Siegel C S et al.Detailed analysis of structures and formulations of cationic lipids for efficient gene transfer to the lung[J].Hum Gene Ther 1996 7(14):1701~1717.
