info@genecompany.com|
基因快讯|


技术交流

扫描二维码
或添加“GeneGroup003”
获取更多更新资讯
商城订购

扫描二维码
或添加“基因商城(GeneMart)”
手机下单,快人一步
售后服务

扫描二维码
或添加“GeneGroup005”
获取更快速售后支持
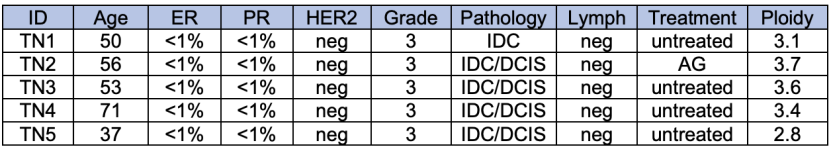
【文章精读】 Cell Genomics|多患者靶向单细胞DNA测序重建乳腺癌突变谱系


研究亮点 研究背景 研究方案设计
课题组:MD安德森癌症中心Nicholas E. Navin实验室
单细胞DNA测序技术已经被广泛应用于解析瘤内异质性。低通量低深度的单细胞全基因组扩增(WGA)帮助我们在全基因组范围内寻找CNV事件,然而分析突变需要更高的测序深度和对特定位点的均一覆盖,需要靶向的高通量单细胞DNA测序。由于基因组区域过大,为了能经济高效利用单细胞DNA测序数据,本研究意在通过WES的测序得到的体细胞突变构建多患者靶向单细胞DNA Panel(Multi-Patient-Targeted Panel),进而分析TNBC的克隆结构和突变谱系。
(1)低深度单细胞WGS:对经过FACS分选的肿瘤来源的非整倍体DAPI染色大于2N的单个细胞核进行低深度单细胞WGS,分析拷贝数变异(CNV)。
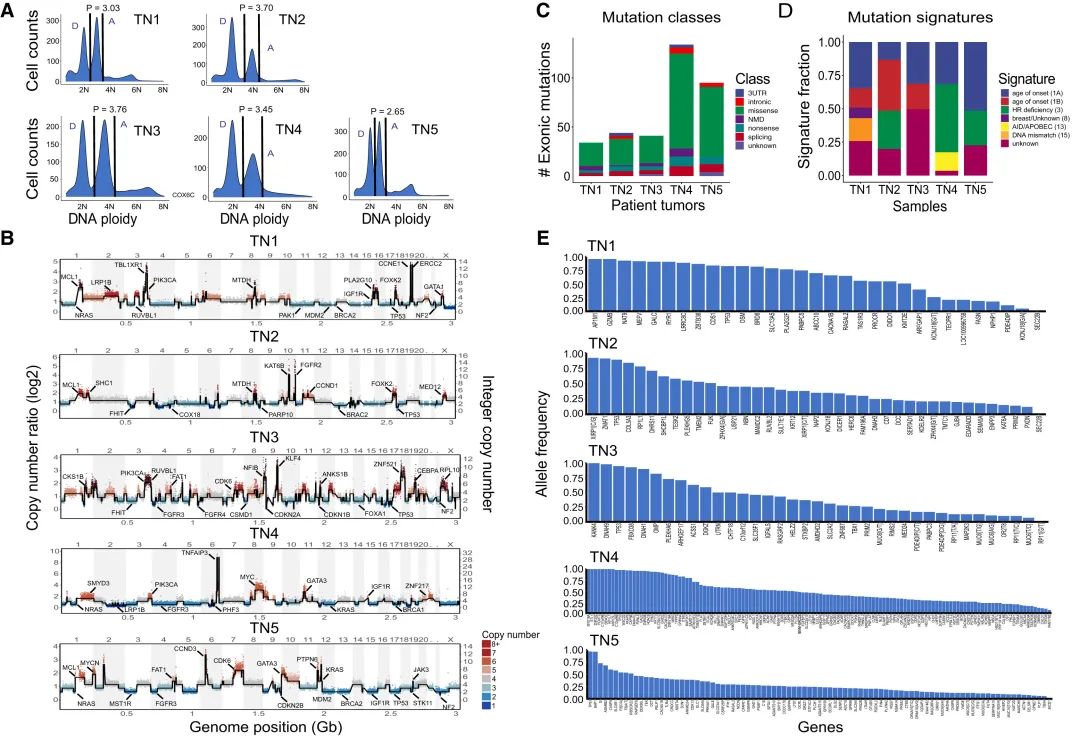
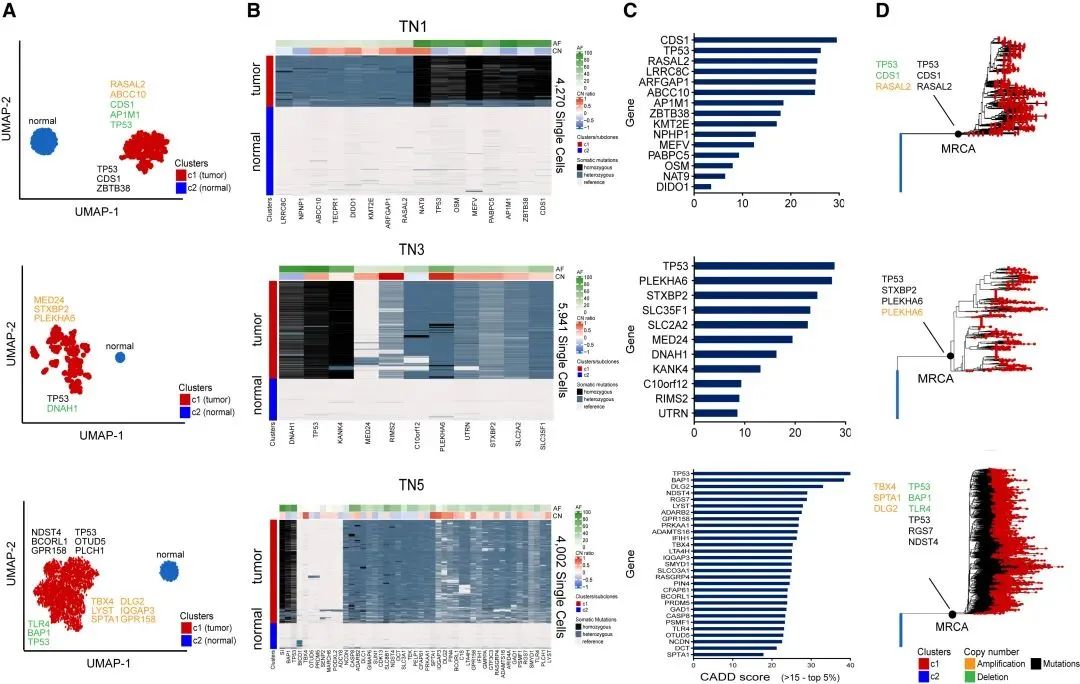
研究结果 TN1、TN3和TN5三个肿瘤均为单个肿瘤克隆,大部分的突变存在在所有的肿瘤克隆中(突变数目:11~47)。此外,在TN5中检测到少量低频突变,可能是在肿瘤进展中后期谱系事件。 图4: 三个单克隆肿瘤的克隆异质性和突变谱系分析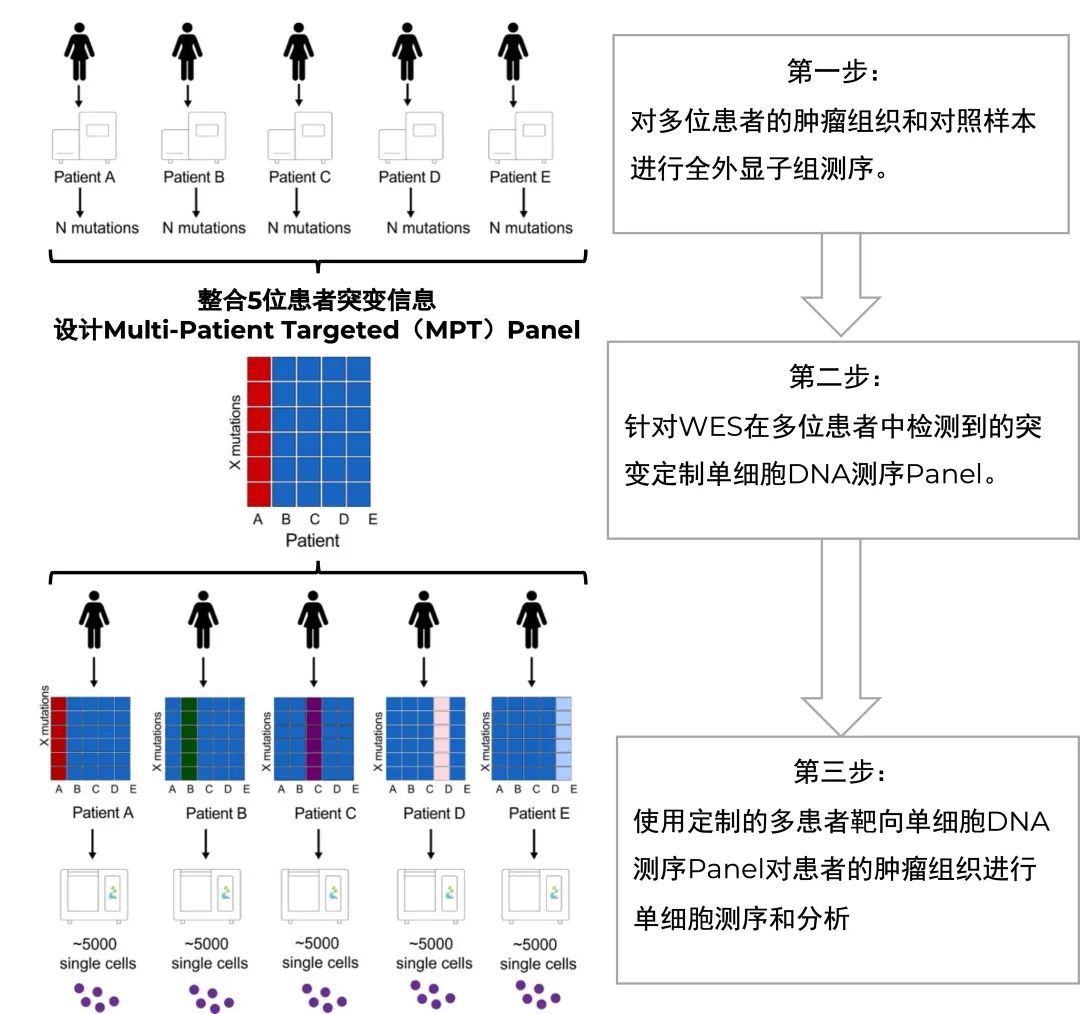
研究方法:针对单细胞WGS的数据和单细胞MPT的数据分别整合为“pseudo-bulk”数据,进行CNV分析比较。相似的,将WES检测结果与单细胞MPT的“pseudo-bulk”分析出的突变VAF进行对比分析。对于克隆结构的分析比较中,WES的VAF结果使用PyClone2进行克隆结构推测,与单细胞DNA测序得到的克隆结构进行比较。
研究发现:CNV的比较显示Pearson相关系数显示高相关值(平均值=0.871),表明跨细胞合并单细胞reads数据,准确反映了pseudo-WGS的CNV结果。值得注意的是,所有高水平的基因扩增均被单细胞MPT测序检出(图5A)。
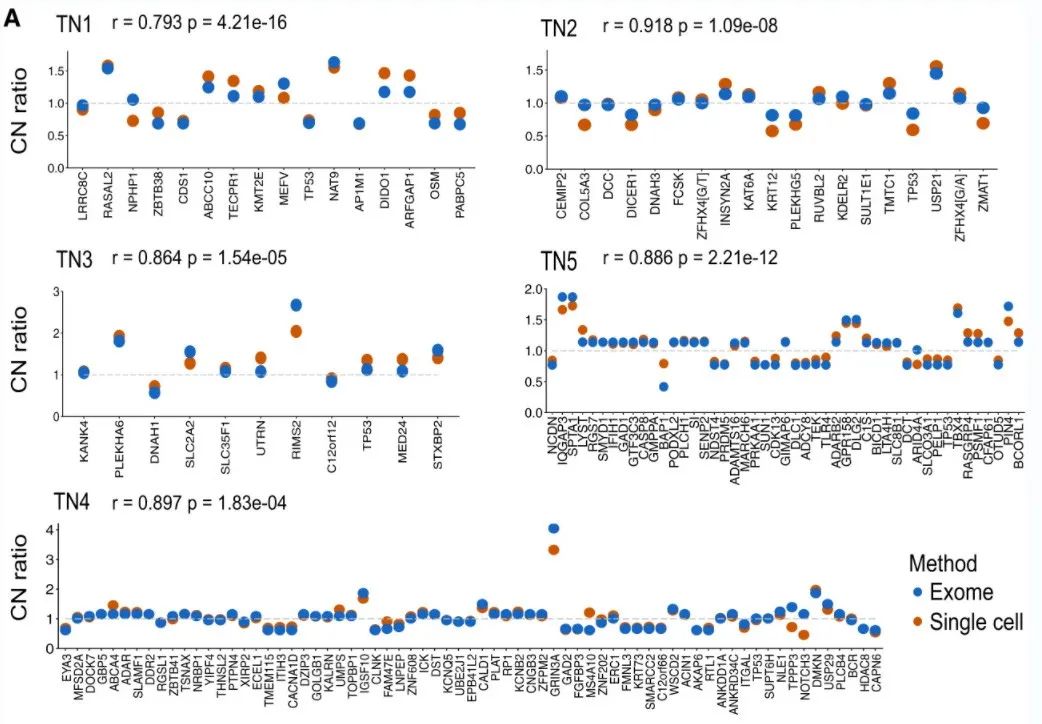
图5A:WGS与单细胞DNA测序检测CNV结果比较
对于等位基因突变频率(VAF)的分析结果显示,WES和单细胞测序两个数据集之间VAF的Pearson相关系数在5名患者中显示出高度相关性(平均值=0.876),表明两者结果高度一致。
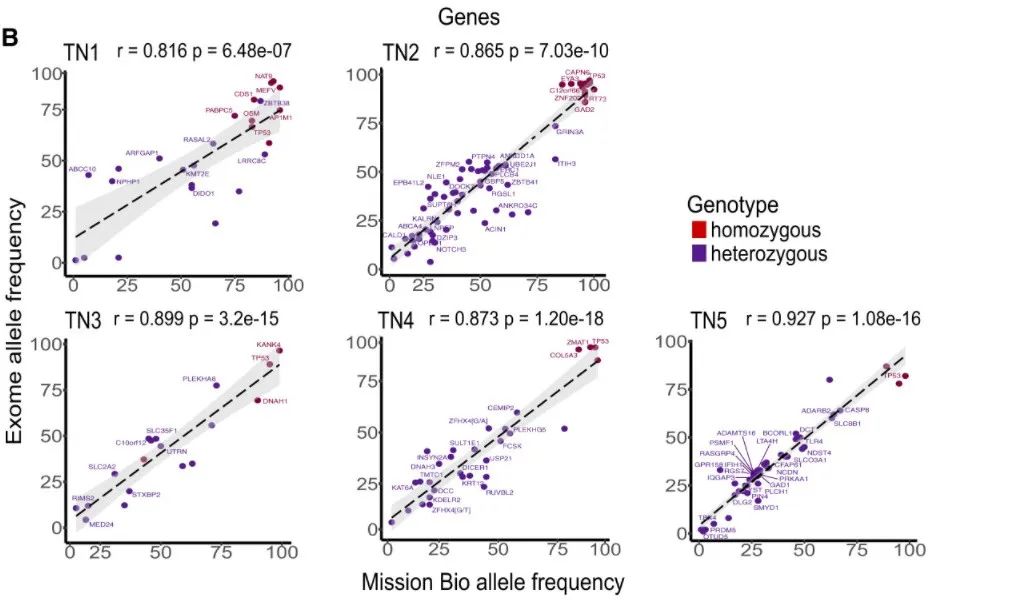
图5B:WES与单细胞DNA测序检测突变结果比较
利用PyClone2对WES分析的突变VAF进行克隆结构的分析,结果显示PyClone2经常高估每个肿瘤中存在的亚克隆数量:其中两个单克隆TNBC肿瘤(TN1、TN5)被估计有 3 个亚克隆。对于这两种多克隆肿瘤,Pyclone2在TN4的外显子组数据中估计了更多的亚克隆(单细胞3个,WES为5个)和TN2(单细胞2个,WES为3个)。这些数据突出了基于Bulk测序得到的VAF推断克隆结构的挑战和不准确性,而单细胞突变数据可以准确解析克隆结构。
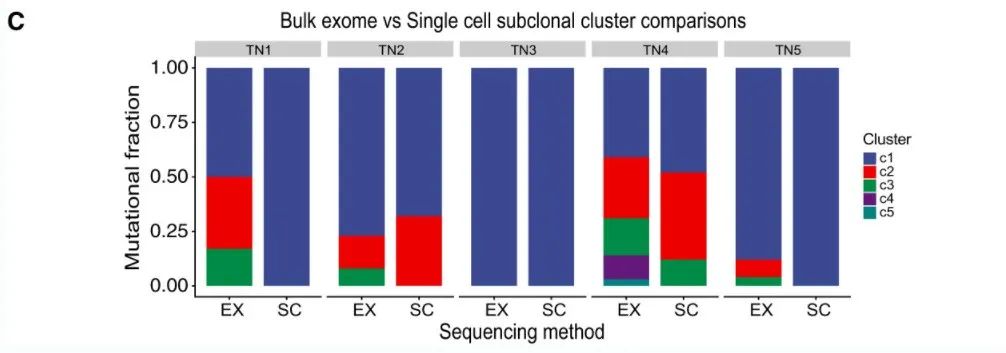
图5C:WES推断出与单细胞DNA测序测得的肿瘤克隆结构比较
该研究报道了通过WES结果进行患者队列进行靶向单细胞DNA测序分析的方法,并成功完成5例三阴性乳腺癌患者的克隆结构和突变谱系分析。单细胞DNA测序结果与bulk WGS和WES的分析结果不仅仅具有高度一致性,多患者靶向单细胞DNA测序(MPT scDNA-seq)能够在不经过分选的肿瘤细胞中高灵敏度地同时检测SNV和CNV。相比于WES推测克隆结构的不准确性,scDNA-seq能够直接、准确测定肿瘤克隆组成,强调了scDNA-seq在分析实体瘤克隆演化和结构的重要价值。
结果显示出,三阴性乳腺癌患者之前巨大的异质性,对于单个患者,存在单克隆和多克隆的不同结构。通过单细胞DNA测序分析出早期发生的主干变异,数据进一步表明,突变也可能在短时间内同时发生,随后是稳定的克隆扩增,形成患者的肿瘤肿块。研究意外发现,在克隆之间存在非常有限的渐进进化中间体的突变。这些数据意味着两种可能性:(1)突变是在短时间的进化中同时获得的,并且在这些事件之外的突变率非常低;(2)存在大的选择性扫描,导致优势克隆胜过其他克隆。根据本次单个时间点的研究结果,研究者无法准确区分这两种情况。
未来的重要方向将包括应用MPT单细胞测序研究早期乳腺癌,如非典型导管增生(ADH)或导管原位癌(DCIS),以更好地了解突变爆发和在更大患者队列中引发乳腺癌的早期事件。此外,将药物反应、生存和进展的临床数据与肿瘤内的数量联系起来也很重要。
作为一家生命科学公司,Mission Bio自2014年成立以来,便致力于为研究人员提供他们所需的工具,以更好地衡量、预测新疗法的抵抗力和反应力,从而加速发现、治愈各种复杂疾病的进程。Mission Bio的多组学方法不仅缩短了新疗法的上市时间,还为治愈癌症提供了细胞和基因疗法的新途径。Mission Bio旗下的Tapestri平台将帮助全球的研究人员检测细胞中的每个分子,从而全面了解单个样本的活性。 Tapestri平台更是唯一的可以提供单细胞DNA和细胞表面蛋白高通量多组学的平台。该平台正在被全球领先的研究中心、制药和诊断公司应用于研究、治疗、治愈癌症的广泛实践中。
基因有限公司于2022年正式成为美国Mission Bio公司的合作伙伴,提供Tapestri系统的售前技术咨询、售后安装培训、应用支持等工作。期待和更多领域先锋一道,攻克疾病研究难题,造福更多患者。如果您对单细胞多组学感兴趣,可以扫描下方二维码进行一对一沟通,或联系您身边的“基因人”。