info@genecompany.com|
基因快讯|


技术交流

扫描二维码
或添加“GeneGroup003”
获取更多更新资讯
商城订购

扫描二维码
或添加“基因商城(GeneMart)”
手机下单,快人一步
售后服务

扫描二维码
或添加“GeneGroup005”
获取更快速售后支持
Cytation系统在3D细胞研究中的应用分享

细胞生长的环境对细胞的结构和功能有很大影响,传统的2D细胞培养方式缺乏仿生环境,不能准确地模拟体内细胞的行为,与此相比,三维(3D)细胞培养方式弥补了单层细胞培养的缺陷,能够更好地模拟生物体内细胞存活的自然环境,其自然条件可保持细胞间相互作用和更逼真的生理生化反应。并且,在3D环境中,细胞对内源和外源性刺激(如温度、pH、营养吸收、转运和分化等方面的改变)应答也更接近于它们在体内的真实水平,因此,3D细胞培养日益成为细胞学研究中必不可少的研究工具。 Agilent BioTek Cytation细胞成像微孔板检测系统作为一款功能强大的活细胞成像检测设备,不仅能够实现明场、彩色明场、相差和多色荧光的检测需求,且其高内涵的Gen5一体化软件还具有Montage拼接、Z轴层扫叠加和3D Viewer的功能,是进行3D细胞研究强有力的检测工具。 应用分享 应用一 使用3D细胞模型和自动化动力学成像方案进行高通量伤口愈合实验
传统的伤口愈合分析常进行划痕实验,即机械损伤愈合的2D细胞层,并测量细胞迁移,但该方法存在一定的局限性,不仅缺乏仿生环境,并且由于划痕方法的不同导致结果难以重复;而新颖的3D伤口愈合分析模型,允许细胞在没有固体基质的情况下自我聚集,使得细胞-细胞和细胞-细胞外基质(ECM)之间的通讯网络得以重建,并通过Cytation细胞成像系统进行自动化动力学成像。
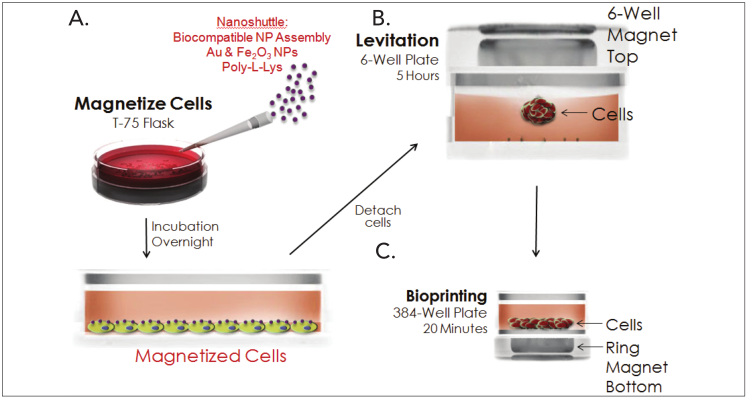
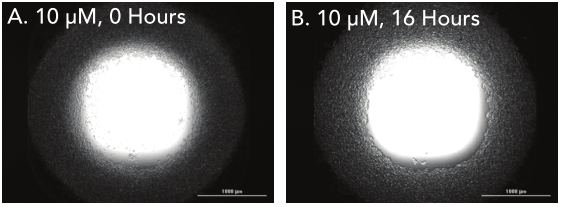
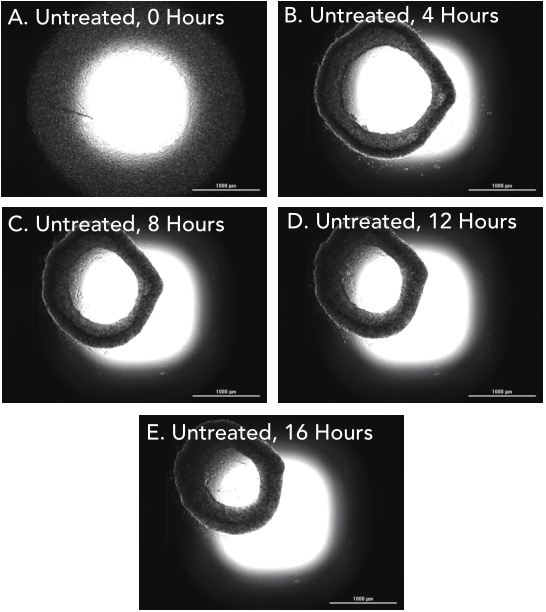
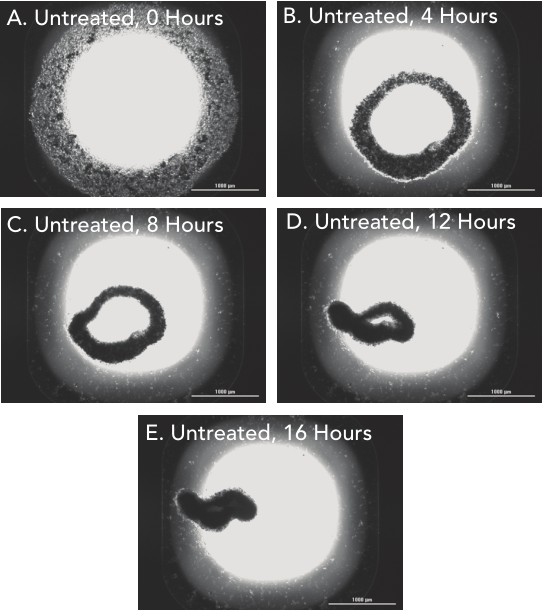
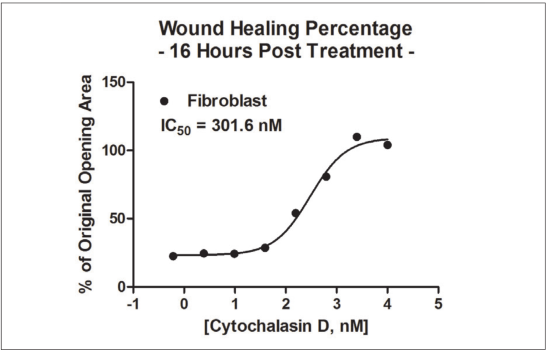
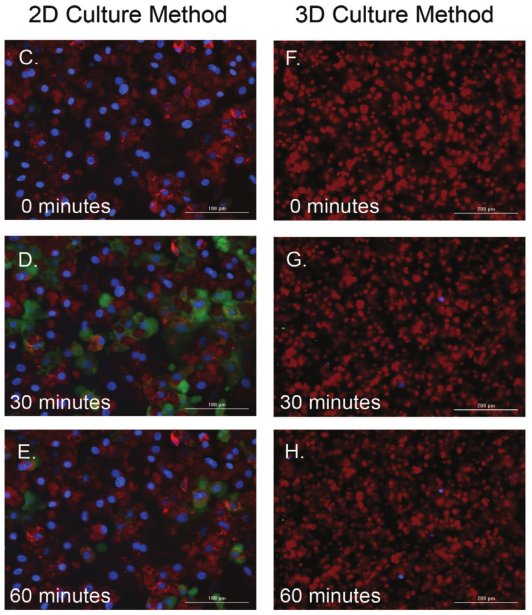
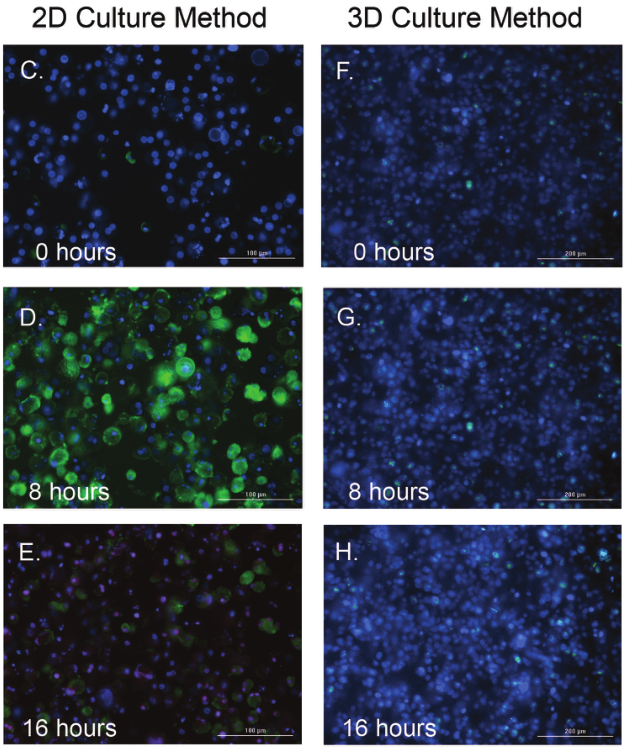
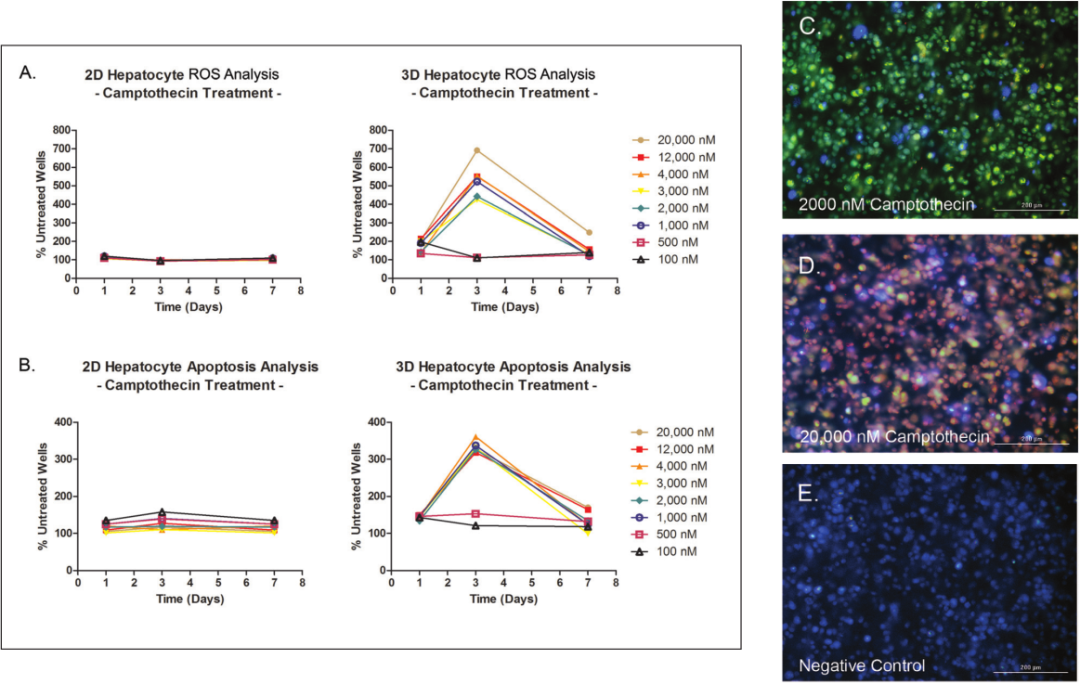
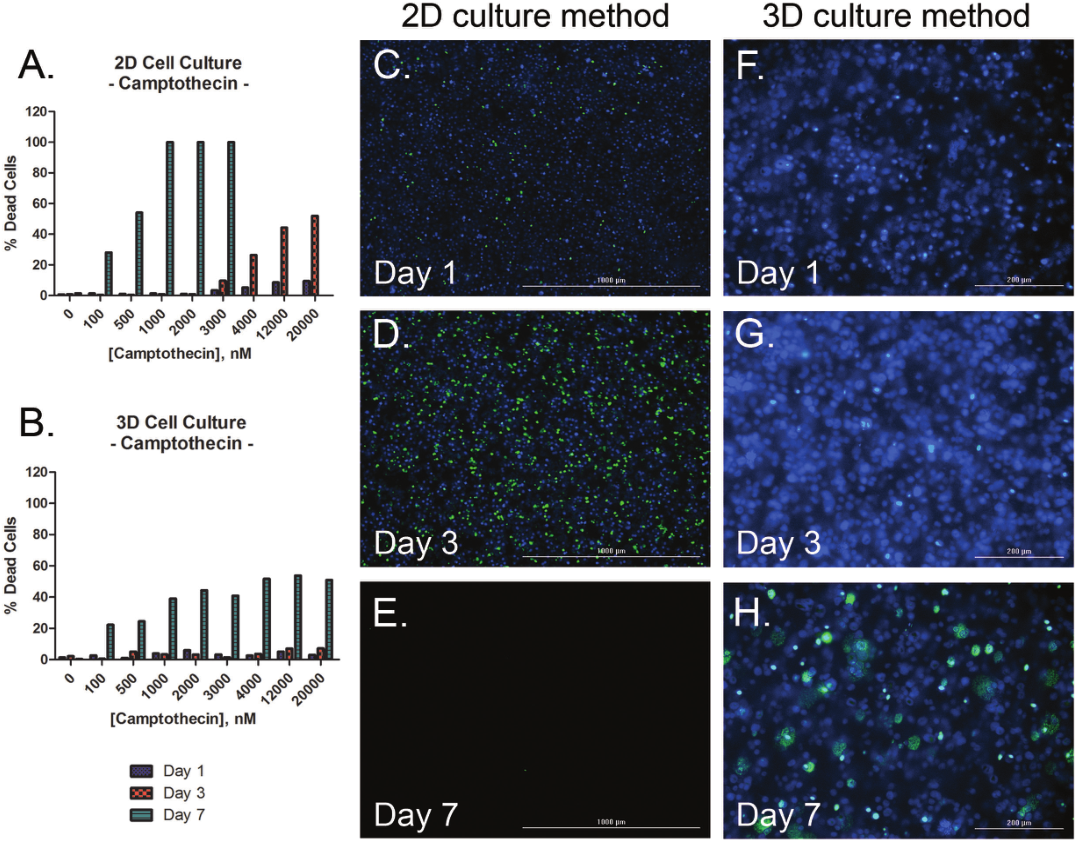
1 材料方法 检测HT-1080纤维肉瘤细胞和原代真皮成纤维细胞两种细胞模型,比较癌细胞系和原代细胞模型之间的伤口愈合率。 图1. 用于伤口愈合分析的3D细胞培养方法。 2 结果分析 HT-1080纤维肉瘤细胞经细胞松弛素D处理后,进行动力学明场成像,结果发现,随着时间推移,环结构没有变化,细胞松弛素D抑制 HT-1080细胞伤口的愈合(图2)。相反,HT-1080在不受抑制的情况下,随时间延长逐渐愈合(图3),与体外伤口愈合实验结果相一致。 图2. HT-1080纤维肉瘤细胞经细胞松弛素D处理后的动力学成像结果。 图3. HT-1080细胞在不受抑制情况下的自然收缩。 最后,通过Gen5软件计算HT-1080 3D细胞环结构在每个时间点的总面积,用于实时伤口愈合分析,并计算细胞松弛素D的IC50值(图4)。 图4. HT-1080细胞伤口愈合IC50计算。 由于癌细胞内部的变化可能会改变细胞模型的迁移特征,因此,该实验以相同的实验条件进行了原代真皮成纤维细胞的伤口愈合分析(图5),同样也进行了胞松弛素D的IC50分析(图6),以检测两种细胞系的差异。结果显示,与癌细胞系相比,使用原代细胞的伤口愈合效率更高,因此,原代真皮成纤维细胞系计算的IC50值明显左移。 图5. 未处理细胞松弛素D的原代成纤维细胞随时间变化的伤口愈合情况。 图6. 原代成纤维细胞伤口愈合IC50计算。 该研究通过nano3D Biosciences公司生产的384孔BiO检测试剂盒和NanoShuttle-PL颗粒,结合Greiner BiO-one Cell-Repellent Surface 6孔和384孔微孔板,提供了一种简单可靠的方法创建3D细胞伤口愈合的高通量检测;而Cytation 5的加入,实现了自动化高通量的成像检测和分析,简化了实验流程,并通过消除人工测定提高了分析的准确性。 应用二 采用一种新的3D细胞培养系统对人原代肝细胞进行体外细胞毒性分析 虽然体内研究是肝毒性评估的金标准,但体外筛选正在以更高的速度进行,因为该方法减少了动物接触,更适合高通量平台,并可以分析细胞的作用机制;在这类毒性研究中,肝细胞通常暴露于一种潜在药物数天,以评估积累效应。但是,传统的2D方式培养的原代肝细胞,容易发生快速的去分化并失去关键功能,此外,以单层形式生长的细胞无法在体内正常形成细胞-细胞及细胞-细胞外基质的通讯网络,而这两个关键缺陷限制了肝毒性研究的发展,妨碍了对药物作用的关键理解。因此,本研究证明了2D和3D方法培养的人原代肝细胞对细胞毒性的反应差异,并通过Cytation系统全面评估了毒素对细胞的影响。 1 材料方法 图1. 使用RAFT系统制备3D肝细胞/胶原蛋白水凝胶。 2 结果分析一 动力学氧化应激检测 氧化应激是一种早期的细胞毒性标记,喜树碱处理后,通过检测活性氧ROS诱导水平从而确定细胞的氧化应激。结果显示,在2D培养的细胞中,喜树碱会引起氧化应激,并且荧光信号在30min达到峰值,而3D培养的肝细胞在处理时间范围内对喜树碱缺乏反应(图2)。 图2. 800 nM喜树碱处理2D和3D细胞后不同时间点的ROS水平检测。(蓝色:Hoechst 33342;绿色:DCFDA;红色:MitoTracker Red CMXRos线粒体探针) 3 结果分析二 动力学凋亡活性监测 凋亡是另一种早期细胞毒性标记,用以确定喜树碱的肝毒性作用,与之前的研究报告一致,即喜树碱会导致细胞凋亡。但与2D培养的肝细胞相比,3D培养的肝细胞没有明显的喜树碱影响,进一步证明了2D和3D培养方法对细胞毒性的反应差异(图3)。 图3. 800 nM喜树碱处理2D和3D细胞后不同时间点细胞凋亡水平检测。(蓝色:Hoechst 33342;绿色:pSIVA试剂。) 4 结果分析三 长时间复合细胞毒性分析 基于以上的实验结果,需要进一步确认,3D细胞是否不受喜树碱的影响,亦或是经历了延迟的ROS诱导和凋亡活性,因此,接下来的研究对2D和3D培养的细胞每天给予不同浓度的喜树碱处理,并在处理后的第1、3和7天进行氧化应激和凋亡活性的终点评估。结果表明,在3D培养的肝细胞中,喜树碱确实会引起氧化应激和凋亡,并且,所引起最大反应时间是在第三天,不同于2D细胞(图4)。 图4. (A.B)2D和3D培养的肝细胞经喜树碱处理后的长期氧化应激和凋亡分析;(C-E)3D培养的肝细胞经喜树碱处理3天后及未处理的细胞毒性检测。(蓝色:Hoechst 33342;绿色:CellEvent Caspase-3/7试剂;红色:CellROX Deep Red氧化应激试剂) 最后,通过长时间孵育检测,以确定早期细胞毒性标记诱导中观察到的变化是否也导致了喜树碱最终细胞毒性效应的差异。对2D和3D培养的细胞再次每天给予一系列喜树碱浓度处理,并在处理后1、3和7天计算总细胞数和死亡细胞数。结果显示,2D和3D培养的细胞在时间和毒性水平上有显著差异(图5),20 μM喜树碱处理的2D细胞在第3天产生50%的细胞毒性,到第7天细胞完全死亡;而相同浓度喜树碱处理的3D细胞在第3天显示只有8%的细胞毒性,在第7天显示51%的细胞毒性。这些结果与上述两种培养模型在ROS诱导和凋亡活性方面的差异一致。 图5.(A.B)不同浓度喜树碱处理下2D和3D培养细胞的死亡百分比;(C-E/F-H)2D/3D培养细胞的细胞毒性分析。(蓝色:Hoechst 33342;绿色:CelTox Green细胞毒性试剂) 该研究表明,3D培养的肝细胞表现出喜树碱的细胞毒性作用,但对该毒素的敏感性低于传统2D培养细胞,可能是由于3D细胞培养物中细胞-细胞和细胞-基质的交流可以创建一个更强大的、生物相关的细胞培养系统;而基于Cytation系统的动力学和终点法检测和分析则为细胞毒性分析提供了强有力的检测工具。 基因有限公司作为Agilent BioTek在中国的合作伙伴,致力于为您提供更加完备的自动化成像检测系统。邀您一同关注我们的官方微信“基因快讯”,如需要了解更多产品信息,可留言或者直接联系基因有限公司。